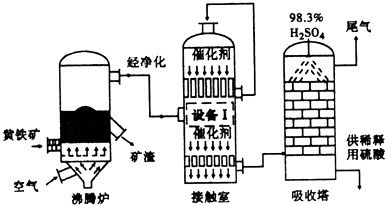
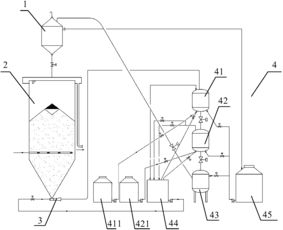
工業上以黃鐵礦(FeS?)為原料,采用接觸法生產硫酸是高中化學中一個重要的工藝流程。其核心步驟包括煅燒、轉化和吸收,該流程也體現了對能源和副產物的綜合利用。
1. 黃鐵礦在沸騰爐中的反應
在沸騰爐中,黃鐵礦與過量的空氣(氧氣)在高溫下發生煅燒反應,生成二氧化硫(SO?)氣體和固體氧化鐵(Fe?O?)。該反應的化學方程式為:
4FeS? + 11O? → 2Fe?O? + 8SO?
這個反應是放熱反應,生成的二氧化硫氣體是后續制取硫酸的關鍵原料。
2. 接觸室中的熱量利用
二氧化硫氣體經過除塵、洗滌、干燥等凈化步驟后,與空氣(氧氣)一同進入接觸室(或稱轉化器)。在接觸室內,二氧化硫在催化劑(通常為五氧化二釩,V?O?)的作用下,被氧化為三氧化硫(SO?):
2SO? + O? ? 2SO? (反應條件:催化劑、加熱)
此反應是可逆的放熱反應。為了充分利用反應放出的熱量,并維持反應所需的適宜溫度(以利于提高SO?的轉化率),接觸室中應安裝熱交換器(或稱換熱器)。其原理是:利用該放熱反應產生的熱量來預熱即將進入接觸室的SO?和O?的混合氣體,使它們達到反應起始溫度。這樣既回收了熱能,提高了能源利用率,又通過控制溫度優化了化學平衡,使反應持續、高效地進行。
知識延伸:工業生產的綜合視角
接觸法制硫酸的整個流程充分體現了綠色化學和循環經濟的理念:
- 能源利用:沸騰爐和接觸室中的反應熱被回收,用于產生蒸汽或預熱原料,降低了能耗。
- 副產物處理:沸騰爐中產生的爐渣(主要成分為Fe?O?)可用于煉鐵或制造水泥。生產過程中產生的尾氣(含少量SO?)需經過處理后才能排放,以防止酸雨。
聯系實際:餐廚垃圾處理中的化學原理
雖然餐廚垃圾處理與硫酸生產是完全不同的工業過程,但兩者都蘊含著重要的高中化學原理:
- 資源化利用:類似于黃鐵礦中的硫元素被轉化為有用的硫酸,餐廚垃圾可以通過厭氧發酵技術,在微生物作用下分解產生甲烷(CH?)(一種清潔能源)和有機肥料。其核心化學反應涉及有機物的分解。
- 化學反應條件控制:如同接觸室中需要精確控制溫度以優化SO?的轉化率,餐廚垃圾的厭氧發酵也需要嚴格控制溫度、pH值和厭氧環境,以促進特定微生物菌群的活性,提高產氣效率和穩定性。
- 環境保護:兩個流程都必須處理可能產生的污染(如硫酸廠的尾氣、餐廚垃圾處理中的滲濾液和異味),體現了化學工業在獲取產品的對環境保護的責任。
接觸法制硫酸不僅是重要的無機化工流程,其體現的能量綜合利用和物料循環思想,與餐廚垃圾資源化處理等現代環保技術所遵循的化學工程原理是一脈相承的。